Ηνωμένα Αραβικά Εμιράτα, Κίνα, Γερμανία, ΗΠΑ, Ηνωμένο Βασίλειο και Ρωσία στην «κούρσα» των εμβολίων που βρίσκονται στην τρίτη κλινική φάση – Ποια είναι τα δεδομένα εννιά μήνες μετά το ξέσπασμα της πανδημίας του κορωνοϊού
Με μία μακροσκελή του ανάρτηση στο Facebook, ο καθηγητής του LSE Ηλίας Μόσιαλος εξηγεί και αναλύει όλα τα μέχρι τώρα δεδομένα για τα εμβόλια για τον κορωνοϊό που βρίσκονται στην τρίτη φάση των κλινικών δοκιμών.
Σε αυτή τη φάση, βρίσκονται τα εμβόλια των Ηνωμένων Αραβικών Εμιράτων, της Κίνας, της Γερμανίας, του Ηνωμένου Βασιλείου και της Ρωσίας. Ο καθηγητής, στο μήνυμά του καταλήγει λέγοντας ότι «στην διαχείριση της πανδημίας, και ειδικότερα στο θέμα των εμβολίων όλα πρέπει να υπόκεινται σε διαφανή έλεγχο, και όλα είναι θέμα ισορροπιών και διαχείρισης ρίσκου. Ένα εμβόλιο με χαμηλή αποτελεσματικότητα και συνεπώς χαμηλή πρόσληψη, δεν θα παρέχει σε μια κοινότητα αρκετή προστασία. Αλλά, επίσης, εάν η αποτελεσματικότητα δεν είναι η βέλτιστη και οι ανεπιθύμητες ενέργειες είναι υψηλές, αυτό είναι πρόβλημα ακόμη και για ένα εμβόλιο που ‘δουλεύει’».
Και τονίζει: «Εάν η αποτελεσματικότητα είναι υψηλή, τότε η ολιγοήμερη δυσφορία σαν μεμονωμένη παρενέργεια είναι ανεκτή».
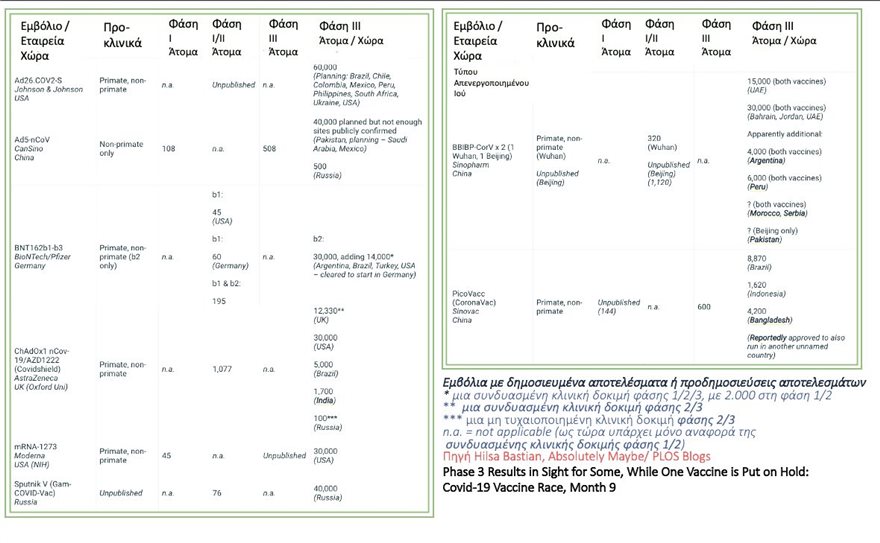
Ολόκληρη η ανάρτηση του Ηλία Μόσιαλου:
«Νέα για τα εμβόλια COVID-19
Που βρισκόμαστε λοιπόν μετά από 9 μήνες; Ας πάμε στο μέτωπο των κλινικών δοκιμών φάσης ΙΙΙ. Τι νέα έχουμε:
• Tα 2 εμβόλια της Sinopharm: η πρώτη μεγάλη κλινική δοκιμή σε φάση ΙΙΙ που έχει συμπληρώσει τον αριθμό των 15,000 συμμετεχόντων -και πιθανώς σύντομα θα έχουμε ανακοίνωση με τα αποτελέσματα- έρχεται από τα Ηνωμένα Αραβικά Εμιράτα (ΗΑΕ). 5,000 εθελοντές για κάθε ένα από τα εμβόλια, συν μια ομάδα ελέγχου 5,000 ατόμων που έλαβε το εικονικό φάρμακο. Αυτή η κλινική δοκιμή ονομάζεται ‘για την ανθρωπότητα’ (4Humanity), και έχει ξεκινήσει μια διεθνής επέκταση της, με επιπλέον 30,000 άτομα. Μέχρι τα τέλη Αυγούστου, άλλα 16,000 άτομα από τα ΗΑΕ είχαν συμμετάσχει – οπότε έχουν περάσει τα μισά του στόχου των 45,000 συμμετεχόντων για τις συνδυασμένες δοκιμές. Χθες ανακοινώθηκε πως τα ΗΑΕ προχώρησαν σε έκτακτη αδειοδότηση εμβoλίου της Sinopharm. Δεν έχουν δημοσιευτεί ακόμη αποτελέσματα.
• Tο τρίτο εμβόλιο από την Κίνα, το Coronavac της Sinovac, για το οποίο διεξάγεται κλινική δοκιμη σε φάση ΙΙΙ στην Βραζιλία: Σύμφωνα με τον πρόεδρο του Ινστιτούτου Butantã που διεξήγαγε τη κλινική δοκιμή, δεν υπήρξαν σοβαρές παρενέργειες, με 4,000 να έχουν λάβει το εμβόλιο. Η δοκιμή αφορά 8,870 εργαζόμενους στον τομέα της υγειονομικής περίθαλψης και αναμένουν να ολοκληρωθεί η κλινική δοκιμή μέχρι τα τέλη Σεπτεμβρίου. Δεν έχουν δημοσιευτεί ακόμη αποτελέσματα.
• Aυτά τα εμβόλια, μαζί με τα εμβόλια της CanSino, έχουν λάβει αδειοδότηση για χρήσης έκτακτης ανάγκης στην Κίνα. Το Coronavac, για παράδειγμα, αναφέρεται ότι έχει δοθεί σε 24,000 άτομα στην Κίνα με πολύ σπάνιες ανεπιθύμητες δράσεις. Για τα 2 εμβόλια της Sinopharm ακούγεται πως έχουν χρησιμοποιηθεί από εκατοντάδες χιλιάδες ανθρώπους.
• Οι ρυθμιστικές αρχές εμβολίων της Κίνας (NMPA) ανακοίνωσαν ότι θα δεχτούν 50% αποτελεσματικότητα, αλλά προτιμούν τουλάχιστον το 70%. (Πρότυπα ισοδύναμα με του Αμερικανικού FDA και του Eυρωπαϊκού ΕΜΑ.)
• Tο εμβόλιο BNT / Pfizer από τη Γερμανία και το εμβόλιο NIH / Moderna από τις ΗΠΑ: και τα δύο ξεκίνησαν τις δοκιμές φάσης ΙΙΙ στις ΗΠΑ στα τέλη Ιουλίου, αν και το BNT / Pfizer είναι μια κλινική δοκιμή που έχουν συμπιεστεί οι 3 φάσεις. Και οι δύο αφορούν 30.000 συμμετέχοντες: η Pfizer έχει ξεπεράσει τους 29,000 και η Moderna τους 23,000 συμμετέχοντες. Στις 12 Σεπτεμβρίου, η BNT / Pfizer ανακοίνωσε ότι ζητούσε την έγκριση του FDA για να επεκτείνει την κλινική δοκιμή σε 44,000 και πιθανώς θα υπάρξει οριστική αξιολόγηση σχετικά με την αποτελεσματικότητα έως τα τέλη Οκτωβρίου
• Για την επέκταση της κλινική δοκιμής, σε συνέντευξή του ο διευθύνων σύμβουλος της Pfizer Αλβέρτος Μπουρλά (Albert Bourla), εξήγησε πως είχαν μεγάλη συμμετοχή από εθελοντές και πως αποφάσισαν να επεκτείνουν την κλινική δοκιμή και να συμπεριλάβουν και άλλους πληθυσμούς, όπως παιδιά ηλικίας 16-18 ετών και άτομα με HIV ή ηπατίτιδα (B και C) για να παρέχουν πρόσθετα δεδομένα ασφάλειας και αποτελεσματικότητας. Είναι ενδιαφέρον πως το εμβόλιο της Pfizer δεν λαμβάνει δημόσια χρηματοδότηση. Όπως δήλωσε ο Δρ. Μπουρλά, το έκανε για να κρατήσει την Pfizer μακριά από την πολιτική σκηνή που συσχετίζεται με το εμβόλιο. Αλλά κυρίως για να μπορέσει να απελευθερώσει τους επιστήμονες του από τη γραφειοκρατία και να τους επιτρέψει να επικεντρωθούν αποκλειστικά στις επιστημονικές προκλήσεις.
• Όσον αφορά το εμβόλιο της Οξφόρδης και της AstraZeneca, έγινε επανεκκίνηση της φάσης ΙΙΙ (στο ΗΒ και στη Βραζιλία αλλά όχι στις άλλες 3 γεωγραφικές τοποθεσίες). Έχει οριστεί πως θα συμμετέχουν 47,000 και αναφέρεται πως έχουν ήδη λάβει το εμβόλιο 18,000 εθελοντές.
Πλησιάζουμε σε ένα μεταίχμιο. Μετά τις ανακοινώσεις των αποτελεσμάτων της τρίτης φάσης των κλινικών δοκιμών και την αξιολόγηση της ασφάλειας και της αποτελεσματικότητας, θα ξεκινήσουν οι συζητήσεις για την αδειοδότηση. Όπως ανέφερα, ο Δρ. Bourla μίλησε για υπεράριθμους εθελοντές, και η Pfizer επέκτεινε την κλινική δοκιμή σε νεότερους και ευάλωτους πληθυσμούς για να συλλέξει πρόσθετα δεδομένα ασφάλειας και αποτελεσματικότητας. Αυτό όμως θα γίνει στα πλαίσια της ελεγχόμενης τυχαιοποιημένης κλινικής δοκιμής της φάσης ΙΙΙ.
Πολλοί ειδικοί της δημοσίας υγείας και επιστήμονες διαφωνούν με τις έκτακτες αδειοδοτήσεις εμβολίων, όποιας χώρας και να είναι η ρυθμιστική αρχή που τις εκδίδει. Εάν μείνουμε καλοπροαίρετοι, και θεωρήσουμε πως δεν υπάρχουν πολιτικές επεκτάσεις πίσω από την έγκριση ενός φαρμάκου η εμβολίου, γιατί χρειάζεται μια έκτακτη αδειοδότηση;
Ποια θα είναι όμως η διαδικασία συλλογής των πρόσθετων δεδομένων αποτελεσματικότητας μετά την έκδοσή της; Θα συνεχιστούν οι τυχαιοποιημένες δοκιμές σε πληθυσμούς που δεν καλύπτονται από την άδεια χρήσης;
Ποιος θα είναι ο αντίκτυπος μιας τέτοιας άδειας σε άλλα εμβόλια που αναπτύσσονται και ίσως είναι καλύτερα; Επιπλέον, πως θα επηρεάσει αυτή η άδεια χρήσης του εμβολίου τη συλλογή των πρόσθετων δεδομένων που χρειαζόμαστε για να υποστηρίξουμε την ευρύτερη χρήση ενός εμβολίου; Χρειάζεται προσοχή, ώστε να μην καταλήξουμε σε κατάσταση αδράνειας όπου οι δοκιμές είναι αδύνατες, αλλά τα δεδομένα είναι ανεπαρκή.
Όπως έχω ξαναπεί, στην διαχείριση της πανδημίας, και ειδικότερα στο θέμα των εμβολίων όλα πρέπει να υπόκεινται σε διαφανή έλεγχο, και όλα είναι θέμα ισορροπιών και διαχείρισης ρίσκου. Ένα εμβόλιο με χαμηλή αποτελεσματικότητα και συνεπώς χαμηλή πρόσληψη, δεν θα παρέχει σε μια κοινότητα αρκετή προστασία. Αλλά, επίσης, εάν η αποτελεσματικότητα δεν είναι η βέλτιστη και οι ανεπιθύμητες ενέργειες είναι υψηλές, αυτό είναι πρόβλημα ακόμη και για ένα εμβόλιο που ‘δουλεύει’.
Εάν η αποτελεσματικότητα είναι υψηλή, τότε η ολιγοήμερη δυσφορία σαν μεμονωμένη παρενέργεια είναι ανεκτή.
Η ‘μπάρα’ λοιπόν για την απόδειξη επαρκούς ασφάλειας θα πρέπει να είναι υψηλή για τα COVID-19 εμβόλια που θα είναι τα πρώτα που θα εγκριθούν για γενική χρήση».
πηγή: protothema.gr











Σημείωση: Τα σχόλια που εμφανίζονται κάτω από τα άρθρα αποτελούν προσωπικές απόψεις των χρηστών που τα δημοσίευσαν και δεν εκφράζουν απαραίτητα τις θέσεις ή απόψεις του Lamianow.gr.
Σε ορισμένες περιπτώσεις, σχόλια που έχουν διατυπωθεί δημόσια σε κοινωνικά δίκτυα ενδέχεται να εμφανίζονται κάτω από τα άρθρα, όταν έχουν δημοσιευθεί κάτω από σχετικές αναρτήσεις του ίδιου άρθρου. Το Lamianow.gr δεν φέρει ευθύνη για το περιεχόμενο αυτών των σχολίων.
Αν κάποιο σχόλιο θεωρείτε ότι παραβιάζει δικαιώματα, είναι προσβλητικό ή έχει αποσυρθεί από την αρχική του πηγή, μπορείτε να επικοινωνήσετε μαζί μας στο lamianow.gr@gmail.com για την άμεση αφαίρεσή του.